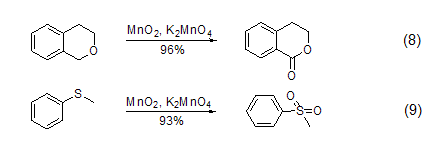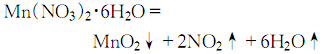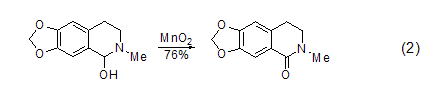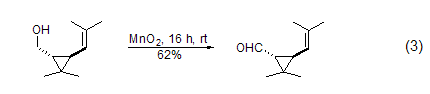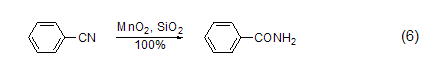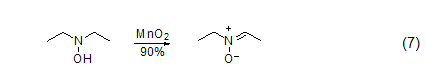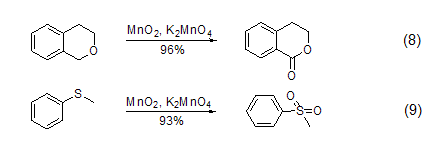分子式:MnO2
分子量:86.93
MDL号:MFCD00003463
EINECS号:215-202-6
RTECS号:OP0350000
物理性质:
1、性状:深棕色粉末
2、熔点(分解,oC):mp 535
3、密度:5.03 g/cm3
4、溶解性:不溶于水和有机溶剂。
化学性质:
1、如果遵照规格使用和储存则不会分解,未有已知危险反应,避免还原剂、易氧化材料、酸、铝和铝合金、卤间化合物.有强氧化性。
2、与冷盐酸反应生成高价氯化锰的棕色溶液,经受热放出氯气并形成氯化锰。在氢气中加热至200 ℃左右,生成三氧化二锰及四氧化三锰。在热浓硫酸中放出氧而成硫酸锰。与苛性钠和氧化剂共熔生成锰酸盐。与硫黄加热时,形成二氧化硫及硫化锰。在高温下遇碳还原成金属锰。420℃时遇一氧化碳还原为一氧化锰。遇双氧水或氯酸钾发生催化分解。加热到535 ℃分解脱氧,生成低价锰的氧化物。
结晶为体心立方晶格(金红石型),a=0.4396nm,c=0.2871nm。可溶于盐酸,不溶于水和硝酸。在空气中于530℃以上放出氧气。γ-MnO2具有活性,特别适于作干电池的阴极材料。这可以看做是βMnO2或者斜方锰矿的微晶或者是它们的中间产物,随着加热逐渐转变为β-MnO2。
储存方法:
保持贮藏器密封、储存在阴凉、干燥的地方,确保工作间有良好的通风或排气装置。
制备路径:
1.硫酸锰法
将菱锰矿粉与硫酸按质量比值l:1.8~1:2.0混合进行反应,生成硫酸锰,正常情况下使用电解槽的循环酸,并补充部分硫酸,待Ph4时,加入少量二氧化锰粉,将溶液中Fe2+氧化成Fe3+,再加石灰乳中和至Ph近中性,加人硫化钡饱和溶液,使重金属离子生成硫化物沉淀,经过滤配制成电解液组成:MnSO4120±20 g/L、H7SO430±10 g/L,在温度93±5℃,槽电压2~3 V下,通常经20~30天电解,在阳极上沉积生成块状粗品,粗品经剥离、粉碎、用水多次漂洗,并加入碳酸氢钠中和至Ph 5~7,再经过滤、干燥、粉碎,制得电解二氧化锰产品。
2.氯化锰法
将菱锰矿与过量盐酸进行反应,生成氯化锰溶液,待反应完成后,加入石灰进行中和,控制Ph4左右,加入氧化剂过氧化氢使Fe2+氧化生成氢氧化铁沉淀而除去,净化的氯化锰溶液加入硝酸锰配成电解液,使氯化锰浓度0.5~2.0 mol/L,HCl的浓度0.01~1.0 mol/L。电解液中可加入含量10%~15%的硝酸锰,在温度85~95℃下电解,这样可解决电解过程中微量氯放出反应所造成的空气污染及腐蚀问题。电解得到纤维状二氧化锰,再经粗品剥离、粉碎、中和漂洗、过滤、干燥、粉碎,制得电解二氧化锰产品。
3.天然锰矿活化法将高质量的软锰矿在空气中加热到600~800℃,或在还原剂(如煤粉、天然气)存在下,加热到300℃进行还原焙烧,使二氧化锰还原生成三氧化二锰,还原产物再经热硫酸处理,歧化三氧化二锰得到高活性γMnO2和硫酸锰,酸浸后浆液经过滤、洗涤、干燥、制得活性二氧化锰。
4.将六水合硝酸锰在空气中于150~190℃下长时间加热就可制得β-MnO2。但是这个合成方法只能得到块状产品,要制取均匀粉末状的产品可采用下述方法:首先,在120~125℃下加热直到全部固化为止,向这种固化产物加水搅拌并过滤,滤渣在110℃下干燥1日后粉碎,再在150~190℃下加热2~3日,则得粉末状β-MnO2。在再加热过程中,若再用沸腾稀硝酸(1∶1~1∶6),接着用沸腾水洗涤,效果更好。另外,也可以将再加热的温度提高到450~500℃。β-MnO2是带有刃形边缘的大颗粒或棒状物。
5.在d=4A·(2θ=28°)的地方检测出散射的X射线衍射图像、结晶初期的产物都称为γ-MnO2。用铅、钛或碳作阳极,电解硫酸锰和硫酸的混合水溶液(90℃),在极板上生成一层γ-MnO2。欲得到微粒状γMnO2,可向硫酸锰和硫酸的混合沸腾水溶液中加过硫酸铵,或者向硫酸锰和硝酸钾的混合热水溶液中添加高锰酸钾即可生成。不论哪一种均为水合物,氧含量比化学计算值稍少一些。
6、在通风条件下,先将试剂水合硝酸锰结晶加热到100℃,然后缓慢升至160℃,使其热分解:
分解终点得到的是黑色粉末状二氧化锰粗品。待冷却后,用少量相对密度为1.34的分析纯硝酸湿润粗品,并搅拌成粥状物后,重新加热至160℃。冷却后过滤,并用相对密度为1.62的分析纯硝酸洗涤二次,重新加硝酸调成粥状,再加热到160℃,冷却过滤,用硝酸洗涤3-4次,于150℃干燥即可。
主要用途:
1.主要用在干电池中作去极化剂。是玻璃工业中的良好脱色剂,可将低价铁盐氧化成高铁盐,使玻璃的蓝绿色转为弱黄色。
2.电子工业中用以制锰锌铁氧体磁性材料。炼钢工业中用作铁锰合金的原料,浇铸工业的增热剂。防毒面具中用作一氧化碳的吸收剂。
3.化学工业中用作氧化剂(如紫红素合成)、有机合成的催化剂、油漆和油墨的干燥剂。也用作火柴工业的助燃剂,陶瓷、搪瓷的釉药和锰盐的原料。还用于烟火,水的净化除铁、医药、肥料及织物印染等方面。
4、在有机合成中,MnO2被用作氧化剂,其反应活性与其结构、制备方法以及溶剂极性有关。
不饱和脂肪醇的氧化 用MnO2能将烯丙基醇转化为α,β-乙烯基醛,当醇或胺存在时,酰基氰化物会醇解或氨解得到相应的α,β-乙烯基酯和氨。炔丙基醇可以被MnO2氧化成烷基醛和酮,而不稳定的炔丙基醛能进一步得到Michael产物 (式1)。
苯基醇和杂环醇的氧化 共轭芳醛或酮可以由MnO2氧化芳基醇得到,而同时很多其它的官能团却不会参与反应 (式2)。
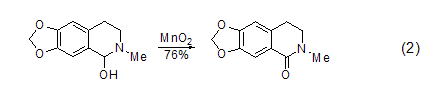
饱和醇的氧化 饱和的脂肪醇和脂肪环醇与MnO2反应可以高产率得到饱和的醛或酮 (式3)。1,2-二醇很容易被MnO2氧化为醛或酮,而1,2-环二醇则反应生成二醛或者是二酮,这在很大程度上决定于反应物的结构。
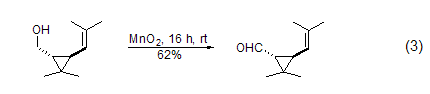
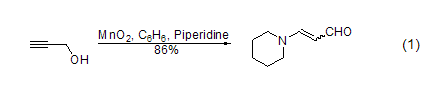
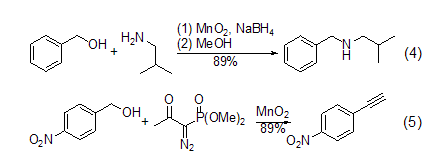
胺与炔的合成 在硼氢化钠存在下,α,β-不饱和烯醇氧化后可以与胺进一步反应 (式4)。一级醇在MnO2氧化后用Bestmann-Ohira试剂处理可以得到端炔 (式5)。
氰基转化为酰胺 在硅胶的参与下,MnO2能把氰基转化为酰胺 (式6)。
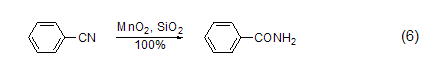
胺类化合物的氧化 用MnO2氧化胺可以得到甲酰胺、重氮化合物等。二烷基羟胺用MnO2氧化会得到相应的硝酮 (式7)。
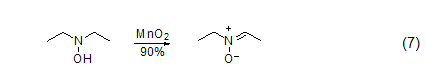
其它反应 MnO2也可以用来发生其它反应,如α-羟基酸的裂解、二芳基甲烷的氧化、二芳基酮的转化、醛到羧酸的转化、由硫制备二硫化物、由磷制备磷化物或是由胺制备酮。此外,近两年兴起的在二氧化锰中添加高锰酸钾的绿色循环方法也有了广泛应用 (式8,式9)。